Au laboratoire du Pr Cédric Blanpain (ULB), spécialiste des cellules souches, on vient d’en apprendre un peu plus sur la manière dont le coeur se développe chez l’embryon. « Une avancée qui pourrait avoir des implications dans la compréhension des maladies cardiaques congénitales qui sont celles les plus fréquemment rencontrées», commente le Pr Blanpain.
Un coeur, plusieurs types cellulaires
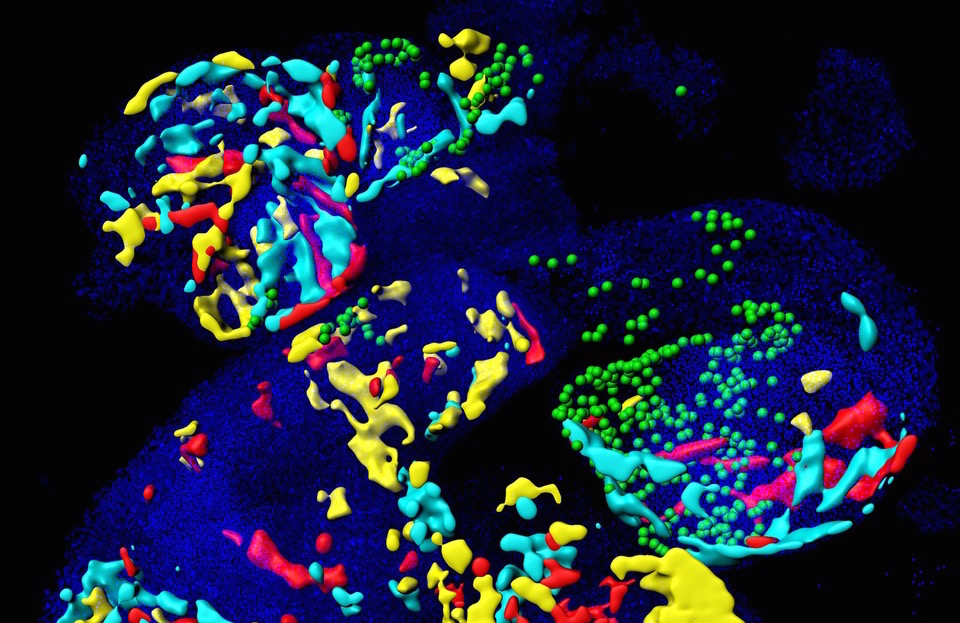
Le cœur est le premier organe formé au cours du développement de l’embryon. Il est constitué de plusieurs types cellulaires aux fonctions bien spécifiques. Les cardiomyocytes assurent le battement du cœur. Les cellules vasculaires tapissent l’intérieur de ses chambres et de ses vaisseaux sanguins. Les cellules « pacemakers » assurent, pour leur part, le rythme cardiaque.
Mais comment, aux premières étapes de la formation de cet organe, les cellules progénitrices à l’origine du cœur se différencient-elles en ces diverses cellules spécialisées? C’est un gène qui détient la clé de cette différenciation: le gène Mesp1. Plusieurs études ont déjà montré que les cellules progénitrices cardiaques étaient issues de différentes populations de cellules exprimant ce fameux gène Mesp1.
Il restait cependant à comprendre quels étaient les mécanismes moléculaires qui permettaient d’orienter les cellules progénitrices vers une région ou un type cellulaire particulier.
Lever le voile sur les mécanismes moléculaires
Un mystère que l’équipe du Pr Cédric Blanpain (ULB) vient de lever. En collaboration avec le Dr Berthold Göttgens, de l’Université de Cambridge, l’équipe bruxelloise a mis en lumière le rôle déterminant de Mesp1 dans les étapes les plus précoces de la spécification cardiovasculaire.
Et, toujours en collaboration avec l’Université de Cambridge, elle a également pu définir les caractéristiques moléculaires des différentes populations de cellules progénitrices cardiaques.
Le Dr Fabienne Lescroart, du Laboratoire du Pr Blanpain, et ses collègues ont d’abord isolé, à différentes étapes du développement embryonnaire, les cellules progénitrices à l’origine du cœur exprimant Mesp1.
Les chercheurs ont ensuite réalisé une analyse des gènes exprimés par chacune des cellules afin d’identifier les caractéristiques moléculaires des cellules progénitrices associées avec une région ou un type cellulaire cardiaque particulier.
Ils ont ainsi démontré que les différentes populations de progéniteurs cardiaques sont moléculairement distinctes et liées à différents types cellulaires et différentes régions du cœur.
Ce constat a permis d’identifier les caractéristiques moléculaires associées à la ségrégation précoce vers une région ou un lignage cellulaire particulier du cœur.
Enfin, les chercheurs ont identifié la ramification la plus précoce entre les lignages cardiaques musculaires et vasculaires au cours du développement embryonnaire : ils montrent que Notch1 marque spécifiquement les progéniteurs engagés vers le lignage vasculaire.
Vers de nouveaux traitements
Comprendre les caractéristiques moléculaires associées avec l’engagement des progéniteurs précoces vers un lignage cardiovasculaire ou une région du cœur particulière semble aujourd’hui extrêmement important pour concevoir de nouvelles stratégies de thérapie cellulaire ciblant les maladies cardiaques: la compréhension de ces mécanismes permettrait, selon les besoins, d’orienter les progéniteurs cardiovasculaires vers une identité cardiaque ou vasculaire d’une région définie.
« Des études complémentaires seront nécessaires afin de déterminer si le paradigme de la ségrégation précoce décrit dans cette étude contrôle également les différents lignages des autres organes et tissus », commente de Pr Blanpain.
« Il sera également important de déterminer si les acteurs moléculaires des progéniteurs cardiaques décrits ici ont un rôle dans l’apparition de malformations cardiaques congénitales et s’ils peuvent être utilisés pour guider les progéniteurs vers un lignage cardiaque particulier, ce qui aurait des implications importantes dans l’amélioration de la thérapie cellulaire destinée à la réparation du cœur », conclut le scientifique, qui cosigne cette étude.