C’est un véritable séisme dans la compréhension des bactéries à Gram négatif, et, par ricochet, dans le domaine des antibiotiques. Jusqu’ici, on considérait que les propriétés de résistance provenaient uniquement du peptidoglycane. Or, l’équipe de Jean-François Collet, professeur à l’Institut de Duve de l’UCLouvain et investigateur au WEL Research Institute, a démontré que cette vision était inexacte : c’est l’ensemble des couches de l’enveloppe des bactéries qui assure leur protection. Ce fonctionnement s’applique à la moitié des bactéries connues aujourd’hui et ouvre la voie à une nouvelle génération d’antibiotiques. « Mieux on connaît les bactéries et leurs moyens de défense, mieux on peut les attaquer ou déjouer leurs systèmes de défense. »
Une enveloppe multicouche
Les bactéries se classent en deux grands groupes : les Gram+ et les Gram-. Leur principale différence réside dans l’épaisseur de leur couche de peptidoglycane, un polymère complexe qui entoure les bactéries. Cette couche est épaisse et directement en contact avec l’extérieur (pas de membrane externe) chez les Gram+, beaucoup plus fine et accrochée à une membrane externe chez les Gram-.
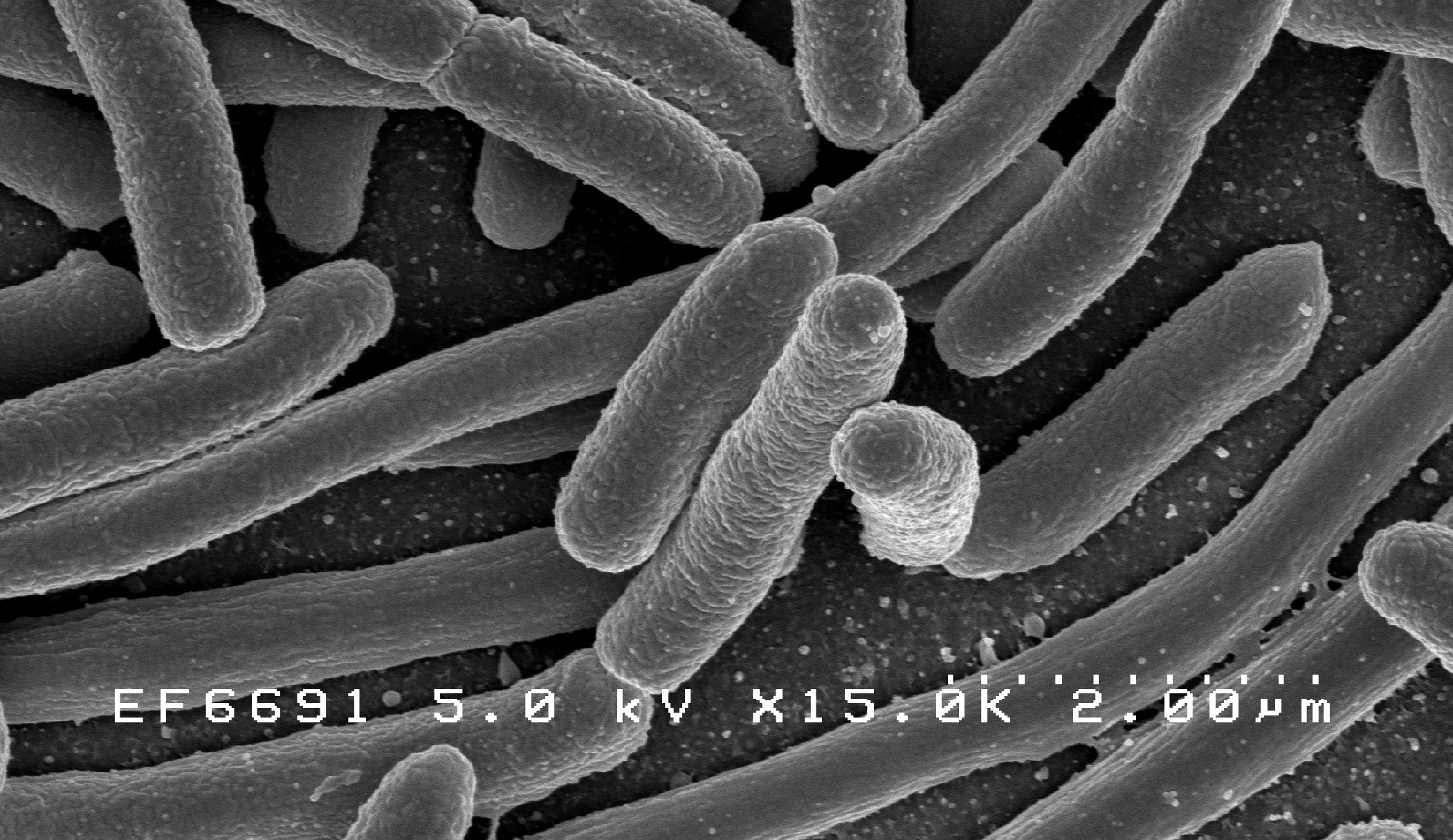
La plus emblématique et connue des bactéries Gram- est Escherichia coli. Bactérie intestinale des organismes à sang chaud, inoffensive voire bénéfique pour l’homme, certaines souches peuvent toutefois aussi être mises en cause dans des intoxications alimentaires ou des infections urinaires. La variante Stec, qui fait couler beaucoup d’encre depuis le décès de huit personnes en Belgique, est une souche d’Escherichia coli qui libère dans l’organisme des toxines (shigatoxines) similaires à celles produites par la bactérie Shigella, responsable de la dysenterie.
Depuis une vingtaine d’années, le Pr Collet étudie l’enveloppe de cette fameuse bactérie E.Coli. « L’enveloppe, c’est ce qui sépare l’intérieur d’E. Coli de son environnement. Depuis les années 1960, on sait qu’elle se compose de trois couches : la membrane interne, la membrane externe, et, entre les deux, le peptidoglycane. »
Changement de paradigme
Jusqu’alors, dans les ouvrages comme dans les articles scientifiques, y compris ceux rédigés par les plus grands spécialistes, on affirmait que le peptidoglycane assurait seul la résistance mécanique des bactéries et les protégeait de la lyse, autrement dit de l’explosion – c’est pour cette raison qu’un grand nombre d’antibiotiques ciblent cette molécule -. « C’était une idée largement répandue, et moi-même j’ai longtemps écrit dans mes articles que le peptidoglycane était la structure de l’enveloppe permettant à la bactérie de résister, par exemple, à la différence de pression osmotique entre l’intérieur et l’extérieur de la cellule. »
Un jour pourtant, au laboratoire, une erreur de manipulation a conduit à un résultat inattendu, impossible à expliquer avec ce modèle. « On aurait pu s’arrêter là, mais nous avons choisi d’aller plus loin. Nous avons mobilisé des approches de biologie cellulaire, multiplié les observations en microscopie et imagerie, mené des expériences génétiques et élaboré un modèle mathématique biophysique. C’est ainsi qu’au bout de 8 années de travail, nous avons fini par démontrer que l’idée selon laquelle le peptidoglycane était la structure qui empêchait l’explosion des bactéries était erronée. »
En réalité, il faut envisager l’enveloppe bactérienne de E. Coli dans son ensemble : les deux membranes, interne et externe, ainsi que le peptidoglycane, forment une seule et même structure mécanique. Ce n’est qu’en association que ces trois éléments empêchent l’explosion de la bactérie. Cet « exosquelette » permet de s’adapter à un environnement très changeant. « Le peptidoglycane n’est qu’une partie d’une structure mécanique plus complète dans laquelle chaque couche a un rôle à jouer. C’est un véritable changement de paradigme ! », explique Pr Colet.
Réinvestir dans la recherche
Parmi les antibiotiques les plus courants, tels que ceux de la famille des pénicillines, certains s’attaquent au peptidoglycane des bactéries Gram-, tandis que d’autres visent la membrane externe. La démonstration que les trois couches de l’enveloppe fonctionnent de manière concertée ouvre désormais la voie à la conception de nouveaux antibiotiques. « Nous collaborons actuellement avec des collègues d’autres laboratoires européens pour identifier des molécules capables de cibler spécifiquement cette association. »
« Avant d’envisager une potentielle collaboration avec l’industrie pharmaceutique, il nous faut d’abord “dérisquer” le projet : identifier des molécules prometteuses et franchir les premières étapes de validation. »
Car, en réalité, la recherche sur les antibiotiques est aujourd’hui un domaine « sinistré ». Pour des raisons économiques, la plupart des grands groupes pharmaceutiques l’ont déserté : leurs laboratoires spécialisés ont été fermés ou réduits à une poignée de chercheurs. La situation est pourtant très préoccupante : dans quelques années, nous pourrions nous retrouver totalement démunis face aux bactéries résistantes.
« En parallèle, quelques start-up osent encore se lancer dans cette voie de recherche avec courage. Mais beaucoup finissent par faire faillite, même après avoir obtenu l’approbation de nouvelles molécules. Le problème est double : d’une part, les antibiotiques sont vendus à bas prix ; d’autre part, lorsqu’un nouvel antibiotique arrive sur le marché, on choisit de le garder en réserve pour éviter une utilisation massive qui favoriserait rapidement l’émergence de résistances. Résultat : les ventes ne décollent pas, et les entreprises ne survivent pas », analyse le Pr Collet.
Les défis économiques sont immenses, mais l’urgence médicale de concevoir de nouvelles stratégies thérapeutiques n’a jamais été aussi cruciale.