Pourquoi un cancer du sein métastase-t-il dans le cerveau, dans les poumons, dans le foie et dans les os, mais jamais dans le lobe de l’oreille ou dans le gros orteil ? Pr Pierre Sonveaux, chercheur à l’Institut de recherche expérimentale et clinique de l’UCLouvain, et son équipe ont identifié une protéine responsable de la migration dans le cerveau des cellules tumorales de cancer du sein triple négatif. Lesquelles développent alors des métastases cérébrales. Autrement dit, sans cette protéine, pas de métastases.
Les cellules tumorales ont le sens de l’orientation
Lors du développement d’un cancer, les cellules tumorales prolifèrent. A tel point et à une telle vitesse que leur environnement devient rapidement hostile : pH très bas, manque d’oxygène et de nutriments. Une compétition pour les ressources s’installe. Un premier senseur indique aux cellules cancéreuses affamées de quitter ce milieu pour survivre.
C’est ainsi que ces cellules tumorales affamées se retrouvent dans le sang à la recherche d’un lieu propice où s’implanter. Ces colonies de cellules cancéreuses, à distance de la tumeur d’origine, portent le nom de “métastases”. Si elles ont besoin de glucose ou de lipide, elles s’arrêteront dans le cerveau. Si elles manquent d’acides aminés, elles préféreront le foie. Si elles ont souffert du manque d’oxygène, le poumon est un bon endroit pour migrer. Enfin, elles préféreront les os, si elles ont besoin de calcium et de phosphates.
«Être informé sur leur situation géographique au sein du corps est la condition sine qua non pour qu’elles trouvent leur lieu de prédilection. C’est là, l’objet de notre découverte. L’hypothèse de notre travail était qu’il y avait un deuxième senseur informant la cellule tumorale sur l’endroit où elle se trouve », explique Pr Sonveaux, chercheur WELBIO et Télévie.
Le choix du cancer du sein triple négatif comme modèle
« Comme modèle, nous avons utilisé le cancer humain du sein triple négatif. C’est un cancer très répandu dans la population. Il est très propice à faire des métastases, et ce, quel que soit le traitement administré. Souvent, les patientes sont diagnostiquées à l’hôpital avant que les métastases se développent, une opportunité pour nous de tenter d’empêcher la survenue des métastases. »
« Lorsque le patient n’a pas de métastase, le monde médical essaie de le guérir avec une thérapie curative. Mais s’il a des métastases, le plus souvent, même s’il existe de nombreuses exceptions, il passe en soins palliatifs, lesquels visent à améliorer la qualité de vie pour le temps de vie qu’il lui reste. La présence de métastases est bien souvent la frontière entre deux traitements », poursuit le directeur de l’équipe Tumor Metabolism (TUMETABO).
« Comme organe de destination, pour nos premiers travaux, nous avons choisi de nous concentrer sur le cerveau, car c’est l’endroit où les métastases diminuent le plus la qualité de vie. »
Des cellules à destination unique
Afin d’identifier le senseur informant la cellule tumorale qu’elle traverse le cerveau, la stratégie de l’équipe louvaniste a été de rendre les cellules cancéreuses très avides pour le cerveau.
« Des cellules cancéreuses humaines ont été insérées dans le « sein » d’une souris 1 immunodéprimée. Comme attendu, des métastases se sont développées un peu partout. Nous avons prélevé les cellules cancéreuses situées dans le cerveau, pour les réinjecter dans une souris 2. A nouveau, le phénomène métastatique a eu lieu avec le développement de cancers secondaires un peu partout, mais avec une prédominance dans le cerveau. Nous avons récupéré des métastases cérébrales qui ont été injectées dans une souris numéro 3, et ainsi de suite, jusqu’à obtenir un cancer qui ne métastasait plus que dans le cerveau », précise Pr Sonveaux.
CQFD
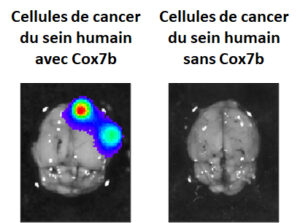
« Ensuite, nous avons utilisé une approche génétique. Celle-ci a révélé qu’une protéine impliquée dans l’alimentation cellulaire, Cox7b, était présente dans les cellules qui vont dans le cerveau, et absente chez les cellules qui n’y vont pas. »
Lors de tests in vitro, les chercheurs ont vérifié que la protéine Cox7b reconnaît bel et bien sélectivement tant un cerveau humain qu’un cerveau de souris.
« Nous avons alors enlevé cette protéine en utilisant une approche expérimentale. Résultat : il n’y avait plus aucune métastase dans le cerveau ! »
«Ensuite, nous avons fait l’expérience inverse : nous avons pris des cellules cancéreuses qui ne vont pas dans le cerveau, nous leur avons ajouté la protéine Cox7b. Résultat ? Elles sont allées dans le cerveau ! »
« Le lien de cause à effet était établi. Avec la première expérience, on a une corrélation. Mais avec les deux expériences, on a une démonstration absolue », explique Pr Sonveaux.
Pas d’espoir de médicament à court terme …
La protéine identifiée, Cox7b, se trouve dans la mitochondrie de chaque cellule métastatique colonisant le cerveau.
Il s’agit non pas d’une enzyme, mais d’une protéine de structure (dont le rôle est d’améliorer la respiration cellulaire). « Cela rend impossible son blocage par un médicament. Il faudrait avoir recours à de la thérapie génétique. Il n’est donc pas possible d’imaginer disposer à court terme d’un moyen thérapeutique contre les métastases cérébrales en ciblant cette protéine particulière. »
… mais une stratégie transposable
« Par contre, ce qui est super intéressant, c’est que l’on a validé une stratégie vraiment efficace. Désormais, en utilisant la même démarche, en prenant toujours le cancer du sein humain comme point de départ, on va viser les protéines qui permettent aux métastases de s’installer dans le foie, dans le poumon, dans les os. On s’attend à ce que certaines d’entre elles soient des enzymes », lesquelles pourront alors être potentiellement bloquées par un médicament.
L’équipe va aussi s’atteler au cancer de la prostate, lui aussi très répandu parmi la population. La même démarche sera suivie afin de déterminer les protéines impliquées dans la migration spécifique (cerveau, foie, poumon, os). « Ce seront peut-être les mêmes protéines que celles identifiées dans le cancer du sein, ou pas. A la fin de nos travaux, nous espérons obtenir une série de protéines parmi lesquelles certaines seront blocables chez l’homme avec un médicament», explique le Pr Sonveaux.
Ces recherches sont réalisées dans le cadre d’un projet WELBIO (cluster d’excellence scientifique de la Région wallonne) consacré exclusivement à l’identification de senseurs de destination dans les cancers du sein, de la prostate et du pancréas.
Concernant le pancréas, les recherches vont déjà bon train, avec l’identification d’une série de protéines qui permettent aux cellules cancéreuses de cibler le foie. Parmi celles-ci, certaines sont des enzymes, potentiellement blocables thérapeutiquement. La validation de ces résultats en est en cours. Avec de grands espoirs à la clé.