Alors que le prix de l’énergie fossile et de l’électricité flambe, le dihydrogène, particulièrement celui produit au départ d’eau, cristallise les espoirs d’une alternative à la fois verte et au prix compétitif. Si la recherche sur la pile à combustible est globalement délaissée par les universités au profit des industriels, les académiques se concentrent sur l’électrolyse de l’eau, sur la production « verte » de dihydrogène (H2). Lors d’une conférence organisée par Liège Créative, Aurore Richel, professeure ordinaire en chimie des ressources renouvelables à Gembloux Agro-Bio Tech-ULiège, a fait le tour de la question.
Des teneurs terrestres marginales
S’il est largement répandu dans l’Univers, notamment au sein d’étoiles, sous forme de gaz ou de plasma, le dihydrogène est, par contre, rare sur Terre. Tout au plus en trouve-t-on de l’ordre de 0,5 à 0,55 ppm dans l’atmosphère. Et dans quelques rares gisements sous-terrain, tels des sources californiennes très basiques et les feux éternels sur le mont Chimère en Turquie, lesquels brûlent du H2 depuis plus de … 2500 ans.
Au vu de sa rareté terrestre, et dans une optique industrielle, l’hydrogène se doit d’être synthétisé en laboratoire.
Des énergies renouvelables pour un hydrogène vert
Entre 1975 et 2018, la production d’H2 n’a cessé d’augmenter, passant de 30 millions de tonnes à 115 millions de tonnes, dont pas moins de 98 % sont issues de ressources fossiles – principalement le gaz naturel et le charbon -. C’est ce qu’on dénomme l’hydrogène gris.
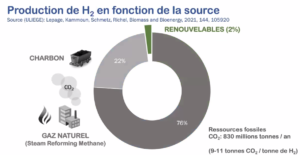
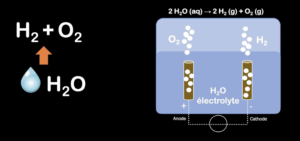
Actuellement, seuls 2 % de l’offre d’H2 actuelle sont synthétisés au départ d’eau. C’est l’électrolyse de l’eau. Mais pour dissocier H2O en O2 et en H2, il faut fournir de l’électricité entre les deux électrodes métalliques, et celle-ci provient encore majoritairement de combustibles fossiles. « Si l’H2 n’est pas carboné en lui-même, sa production repose sur des ressources fossiles carbonées, émettant des gaz à effet de serre. On estime schématiquement que la production d’une tonne de H2 au départ d’eau génère de 9 à 11 tonnes de CO2. »
Sauf si l’électrolyse est réalisée au départ d’énergies renouvelables. C’est le H2 vert. Des chercheurs de l’ULiège planchent sur cet aspect. « Actuellement, le H2 vert est plus cher que le H2 gris. Cela est lié aux investissements industriels, mais aussi aux difficultés technologiques rencontrées lors de l’électrolyse de l’eau. Nous travaillons, notamment, à améliorer les métaux, la nature des électrodes. » Un autre challenge pour la recherche sera de diminuer la quantité d’énergie, actuellement gigantesque, requise pour réaliser l’électrolyse de l’eau de façon industrielle.

À droite : Stratégie de photocatalyse. C’est-à-dire séparation de H2O avec deux électrodes métalliques, et ajout d’un catalyseur opérationnel avec l’apport d’énergie lumineuse. De quoi améliorer la décomposition de l’eau en O2 et en H2 © Laetitia Theunis – capture d’écran de la présentation d’Aurore Richel – Cliquez pour agrandir
La production d’engrais, gourmande en H2
Le dihydrogène fascinait les scientifiques de la fin du 19e siècle et du début du 20 e siècle. C’est à cette période que la majorité des connaissances le concernant ont été acquises. C’est aussi à ce moment qu’il fut imaginé de l’employer pour fabriquer d’autres composés chimiques.
Ainsi, Sabatier, un chimiste français, a décrit des réactions de combinaison de H2 avec du CO2 pour générer du méthane. Dans la foulée, deux autres réactions d’intérêt voient le jour : la production de méthanol et celle d’ammoniac, toujours au départ de H2.
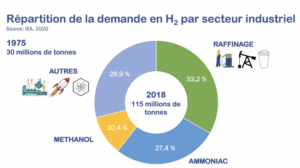
« Tant le méthanol que l’ammoniac sont aujourd’hui considérés comme des molécules plates-formes, des molécules de base pour l’industrie chimique. L’ammoniac sert notamment à synthétiser des engrais azotés », explique Pre Richel. Sur les 115 millions de tonnes d’H2 produits en 2018, 27,4 % ont été consommés pour fabriquer de l’ammoniac et 10,4 % pour le méthanol.
Autre glouton, le raffinage du pétrole
« Le H2 est également utilisé en pétrochimie, plus précisément dans le processus de fabrication des carburants. Notamment, en enlevant le souffre par des procédés de désulfurisation, ce qui facilite leur transport aérien, maritime, et routier. En 2018, 36 millions de tonnes d’H2 (soit 33,2%) ont été destinées au raffinage du pétrole.»
Et les 28,9 % restants ? Ils sont partagés entre différents secteurs. Par exemple, la métallurgie, le médical et l’agroalimentaire. Notamment via l’hydrogénation catalytique, méthode qui transforme une huile végétale liquide en margarine.
Mais aussi dans la propulsion aérospatiale. « Alors que les premières missions Apollo étaient affrétées avec l’H2 liquide, cette solution technologique est encore envisagée par la Nasa pour les prochaines missions spatiales. L’agence spatiale américaine détient encore de nombreux brevets dans ce domaine. Et d’autres sociétés aérospatiales, comme Blueorigin, continuent d’en déposer », précise Aurore Richel.
La pile à combustible, le Graal des transports électriques?
Enfin, le dihydrogène pourrait se faire une place de choix dans le domaine du transport. Et ce, via la pile à combustible ou pile à H2.
Lorsque H2 se combine avec O2, cela donne H2O. « Cette réaction est très exothermique, c’est-à-dire qu’elle dégage beaucoup de chaleur : trois fois plus que le méthane ou les carburants de roulage traditionnel (essence ou diesel). Elle dégage également beaucoup d’électricité qui pourrait être mise à profit pour les moyens transports électriques. »
Grâce à son absence d’émissions carbonées, et l’eau étant son seul élément chimique résiduel, cette réaction de pile à combustible est considérée comme propre. Et intéresse en ce sens moult industriels automobiles et autres, qui déploient massivement de la R&D dans ce domaine. C’est d’ailleurs la principale raison qui explique le désintérêt de la recherche universitaire autour de la pile à combustible.
« A peine 1000 publications scientifiques sont émises par an sur la pile à combustible. C’est bien moins que sur les carburants de roulage liquide issus des ressources renouvelables (5000 en 2020). La pile à combustible n’est plus tellement à la mode en recherche fondamentale au sein des universités car elle représente beaucoup d’enjeux : les industriels s’en sont emparé.»
Le stockage, la pierre d’achoppement
L’hydrogène présente un problème majeur : son stockage.
Aux pression et température terrestres, le dihydrogène est un gaz parfait, doté de très bas points de fusion et d’ébullition. « Dès lors, pour le faire passer à l’état solide ou liquide, et ce, afin de faciliter son stockage, il faut appliquer une température basse et/ou une pression relativement élevée. Et cela nécessite d’utiliser beaucoup d’énergie. »
Le dihydrogène est la molécule la plus légère et la plus menue du monde de la chimie. « Avec sa petite taille, elle passe parfois entre les parois des matériaux qui servent à le stocker. Il faut donc également concevoir des matériaux imperméables à l’H2 », conclut Pre Richel.

