Si la brucellose est éradiquée depuis de nombreuses années en Europe du Nord, elle reste très présente dans les pays en voie de développement. Et même si on peut la soigner, elle semble être capable de devenir chronique et de resurgir du jour après des années d’absence.
C’est une des raisons pour lesquelles, Brucella, la bactérie responsable de cette maladie continue d’intriguer les scientifiques. En particulier, le Pr Xavier De Bolle et ses collègues de l’Unité de recherche en biologie des micro-organismes (URBM) de l’Université de Namur.
Au cœur des cellules animales
Avant d’infecter l’homme, cette bactérie élit domicile dans les cellules d’animaux comme les chèvres ou les vaches. Ces animaux sont ses hôtes principaux, l’homme n’est finalement qu’un hôte secondaire qui se contamine en buvant du lait non pasteurisé provenant d’un animal infecté, par exemple.
« Pour bien comprendre comment Brucella se développe et se propage, il faut se plonger au cœur de cellules animales infectées », explique Xavier De Bolle. « Impossible, évidemment, d’amener une vache dans un laboratoire comme le nôtre. Nous avons donc développé un modèle d’infection cellulaire qui nous permet de suivre en détail le développement de Brucella au sein même de son hôte ».
Souvent, les chercheurs étudient la bactérie dans un milieu chimique où ils étudient le comportement de la cellule hôte en contact avec la bactérie. « Nous, et c’est cela qui est original, nous avons étudié le cycle cellulaire de la bactérie dans la cellule hôte, donc dans la cellule du mammifère », précise le spécialiste namurois.
Des travaux à la croisée de deux disciplines : l’étude de la relation hôte-pathogène et l’étude du cycle cellulaire.
Suivre le chemin de Brucella
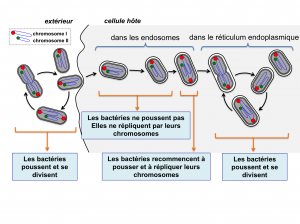
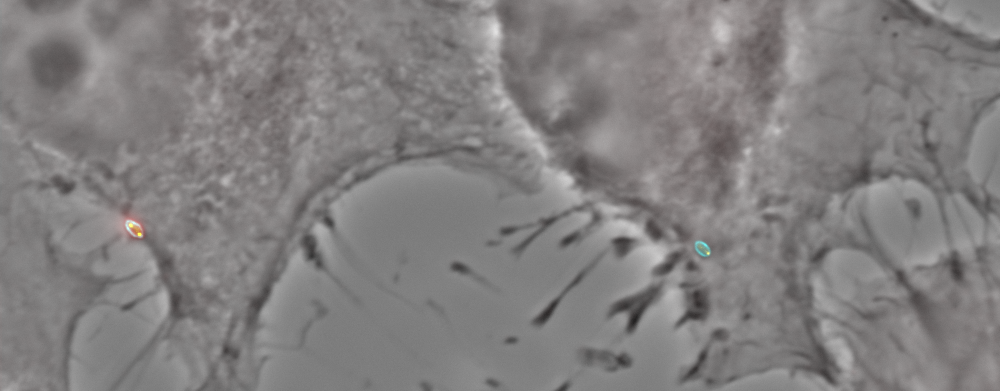
Première étape de ces travaux : localiser Brucella au sein de la cellule hôte. Celle-ci ne se loge pas dans un seul site. Elle occupe au moins deux positions différentes. D’abord dans des compartiments appelés endosomes. Ensuite, elle migre dans le réticulum endoplasmique, une structure qu’on ne rencontre que chez les cellules eucaryotes, une sorte de réseau capable d’établir la communication interne entre les organites de la cellule.
« Ce qui nous a étonnés au début, c’est que Brucella soit capable de rester plusieurs heures dans les endosomes, un site très hostile où elle est soumise à des attaques acides et à des chocs oxydatifs » reprend le Dr De Bolle, « elle est bien plus tranquille dans le réticulum endoplasmique».
Une constatation qui amène d’autres questions: comment se comporte cette bactérie dans les cellules hôtes ? Comment s’y cache-t-elle pour échapper à la réponse immunitaire ?
Le cycle cellulaire sous les projecteurs
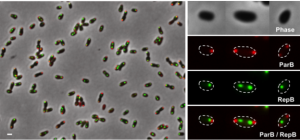
Pour tenter d’y répondre, les chercheurs namurois ont mis au point une technique de marquage fluorescent qui leur permet de suivre facilement le cycle cellulaire de ces bactéries et qui leur a valu une publication dans la revue Nature Communications . Le marquage fluorescent permet, par exemple, de voir si la cellule grandit ou copie ses chromosomes et comment elle le fait.
« Grâce à cette technique, nous avons vu que la bactérie ne se développe pas de manière bilatérale : elle grandit uniquement d’un côté, unilatéralement. Ce qui nous a le plus surpris, c’était de constater que Brucella ne copie pas ses chromosomes lorsqu’elle est au sein des endosomes. Une fois dans cet organite, elle cesse de croître, elle entre en latence ».
Brucella reprend sa croissance et la copie de ses chromosomes juste avant d’entrer dans le réticulum endoplasmique. « Dès qu’elle y est, son cycle cellulaire reprend son rythme et elle commence à se multiplier », détaille encore le chercheur. Cette alternance entre latence et multiplication pose question. Cesser de se multiplier lui permet-elle de mieux résister aux attaques dans les endosomes ? Quel est l’avantage évolutif de cette période de latence ? Autant de questions auxquelles le chercheur et son équipe vont désormais tenter de répondre.
Une découverte importante pour l’antibiothérapie
Les résultats actuels fournissent déjà des informations fondamentales sur le cycle de Brucella. Et ils ouvrent de nouvelles pistes de réflexion pour une prise en charge plus efficace de la maladie et pour la mise au point de stratégies vaccinales.
Ils posent aussi un regard différent sur l’antibiothérapie. « De manière générale, les antibiotiques ciblent des bactéries qui sont en pleine multiplication. Par conséquent, Brucella au sein de l’endosome est une très mauvaise cible pour les antibiotiques. Nos résultats montrent donc qu’il faut également apprendre à composer avec des bactéries en latence et Brucella n’est très certainement pas la seule », conclut le Dr Xavier De Bolle.

[…] Pr Xavier De Bolle et ses collègues de l’Unité de recherche en biologie des micro-organismes (URBM) Si la brucellose est éradiquée depuis de nombreuses années en Europe du Nord, elle reste très présente dans les pays en voie de développement. Et même si on peut la soigner, elle semble être capabl… […]