Les myopathies sont des maladies musculaires dont les symptômes et l’évolution varient beaucoup d’une personne à l’autre. La plus connue d’entre elles est la myopathie de Duchenne qui touche 1 garçon sur 3600.
Point commun aux diverses formes de myopathies : elles se caractérisent toutes par une perte progressive de la force musculaire. Pour certains types de myopathies, cela s’accompagne d’une diminution de la masse musculaire. Reste que chez certains, la perte de force musculaire évoluera très vite d’une année à l’autre alors que chez d’autres, elle évoluera plus lentement.
Cette faiblesse musculaire caractéristique des myopathies peut gagner tout l’organisme : les muscles qui participent à la marche, les muscles des membres supérieurs, ceux participant à la déglutition et même les organes vitaux comme les poumons et le cœur.
« Lorsque les muscles respiratoires sont touchés, il devient alors difficile de tousser pour se débarrasser du mucus qui encombre les poumons, ce qui crée un terrain favorable pour les infections pulmonaires », explique le docteur Patsy Renard , chercheur au sein de l’Unité de Recherche en Biologie Cellulaire à l’Université de Namur (UNamur) grâce au soutien de l’Association Belge contre les Maladies neuro-Musculaires (ABMM).
Myopathies d’origine nucléaire ou mitochondriale
« Ces maladies musculaires ont des origines diverses mais la plupart sont d’origine génétique : elles sont, par exemple, liées à une mutation ou à une délétion au sein d’un gène. Ces altérations génétiques peuvent toucher l’ADN du noyau, ou l’ADN des mitochondries, on parle alors de myopathies mitochondriales et c’est précisément sur ce type de myopathies que nous travaillons, avec le professeur Thierry Arnould de l’UNamur», indique le Dr Renard.
Au cœur des centrales énergétiques de l’organisme
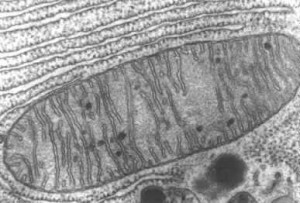
Pour mieux comprendre les mécanismes d’apparition des myopathies mitochondriales, il faut plonger au cœur des mitochondries. Celles-ci sont de petits compartiments cellulaires extrêmement importants, puisqu’ils sont les centrales énergétiques de l’organisme.
Ce sont elles qui produisent l’énergie nécessaire pour les différentes fonctions cellulaires : l’entretien des cellules, leur multiplication, la contraction des fibres musculaires, etc.
Lorsque les mitochondries ne fonctionnement pas correctement, cela se traduit notamment par un déficit énergétique. Les tissus musculaires et neuronaux étant les plus gros consommateurs d’énergie de l’organisme, ce sont généralement les premiers touchés.
« Dans le cas des myopathies mitochondriales, les mitochondries ont un comportement anormal parce que les gènes de l’ADN mitochondrial ont subi une altération. Résultat, les protéines produites par cet ADN sont défectueuses soit par leur qualité, soit par leur quantité, et la production d’énergie qui en découle n’est pas suffisante ».
Une communication rétrograde
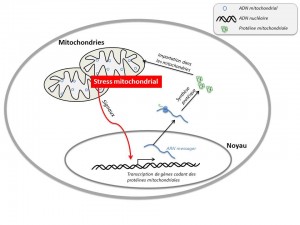
Ces mitochondries contiennent un petit génome qui leur est propre mais la plupart des protéines qui sont présentes dans ce compartiment cellulaire sont codées par le génome localisé dans le noyau.
Il existe donc un dialogue permanent entre les mitochondries et le noyau afin d’assurer le bon fonctionnement de celles-ci. Si les mitochondries subissent un stress, par exemple provoqué par une mutation dans le génome mitochondrial, elles envoient des messages au noyau pour qu’il exprime les gènes susceptibles de résoudre ce stress. C’est ce qu’on appelle la communication rétrograde.
« L’interprétation que nous faisons de ce phénomène de communication rétrograde est donc une réponse en principe positive puisqu’elle permet de compenser – dans une certaine mesure – un déficit mitochondrial. Mais dans le cas de certaines myopathies, comme les myopathies MERRF et MELAS, le système s’emballe et aboutit à une hyper-prolifération des mitochondries au sein des fibres musculaires : celles-ci finissent par s’agglomérer et forment des structures qui ressemblent à des cristaux. Malheureusement, ces agglomérats de mitochondries fonctionnent très mal. Pire : on constate que la présence de ces fibres striées squelettiques est corrélée à un taux élevé de mort cellulaire des fibres musculaires. Ce qui pourrait expliquer la perte musculaire caractéristique de ce type de myopathies ».
Identifier les molécules clés de cette communication
C’est précisément sur cette communication rétrograde que l’équipe de Patsy Renard a axé ses recherches ! Ils ont avons décidé de se concentrer sur une catégorie bien précise de régulateurs cellulaires : les microARNs.
« Il s’agit de courtes molécules d’ARN dont la séquence est complémentaire de certains ARN messagers : lorsqu’un microARNs se lie à un ARN messager, il provoque sa dégradation ou empêche sa traduction en protéine. La présence d’un microARNs particulier permet donc de contrôler l’abondance des protéines qui seront synthétisées à partir d’un ARN messager cible. Ce mode de régulation, découvert récemment, est puissant car un ARN messager peut être contrôlé par plusieurs microARNs de séquences différentes, et à l’inverse, un microARNs peut cibler plusieurs ARN messagers différents. On a identifié environ 1400 microARNs différents chez l’homme, et pour toutes les fonctions de la cellule étudiées jusqu’à présent, on a pu montrer qu’elles étaient contrôlées par des microARNs. Nous avons donc formulé l’hypothèse que des microARNs devaient être impliqués dans la communication rétrograde. Nous avons déjà identifié une liste de microARNs dont l’abondance est modifiée lorsque la mitochondrie fonctionne mal. L’étape à réaliser maintenant est de sélectionner judicieusement quelques microARNs parmi ceux-ci, de les surexprimer ou de les sous-exprimer pour voir ce qui se passe dans la communication rétrograde et le comportement des mitochondries. Lorsque nous pourrons proposer un mécanisme d’action de ces microARNs dans la régulation du fonctionnement mitochondrial, nous chercherons si cela se vérifie dans des muscles de patients atteints de myopathies mitochondriales ».
Les pistes d’un traitement ?
Les travaux menés à l’UNamur sont de l’ordre du fondamental. On est donc loin de la mise en place d’un traitement contre les myopathies. Cependant, les microARNs sont actuellement testés en phase clinique dans le cadre de thérapie contre le cancer.
S’ils s’avèrent intéressants dans le cas des myopathies, les microARNs seront une bonne base de travail dans la mise au point d’un arsenal thérapeutique.

