Série : SLEEP (3/5)
57 millions. C’est le nombre de personnes qui souffrent de démence à travers le monde, selon les dernières données de l’Organisation mondiale de la santé. Un chiffre qui continue inlassablement de grimper, avec près de 10 millions de nouveaux cas chaque année. La maladie d’Alzheimer (MA) représente 60 à 70 % des cas. En Belgique, on estimait que plus de 138 000 personnes étaient concernées en 2018. La maladie de Parkinson (MP), seconde maladie neurodégénérative la plus fréquente après Alzheimer, connaît une prévalence en forte hausse, ayant doublé en 25 ans. Elle affecte près de 40 000 personnes dans notre pays.
Ce qui rend ces maladies particulièrement insidieuses, c’est leur évolution lente et silencieuse : des décennies peuvent s’écouler avant que les premiers symptômes ne se manifestent. Et lorsqu’ils apparaissent, des changements irréversibles ont déjà eu lieu dans le cerveau. Face à ce défi, la recherche s’attache à identifier les facteurs de risque, ceux qui favorisent leur développement. De plus en plus d’études suggèrent qu’un sommeil perturbé serait l’un d’eux.
Tau, amyloïdes et alpha-synucléine …
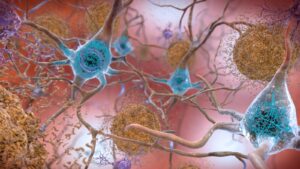
Les maladies de Parkinson et d’Alzheimer entraînent toutes deux une détérioration progressive des neurones, causant soit des déficits cognitifs, soit un handicap physique, voire les deux. Bien que le déclencheur de cette neurodégénérescence soit encore discuté, la recherche a établi que ces pathologies se caractérisent par une accumulation de protéines perturbant le fonctionnement normal des neurones, jusqu’à les tuer.
On sait que les troubles moteurs de la MP sont liés à un déficit en dopamine, une molécule impliquée dans le contrôle des mouvements. Il résulte d’une perte progressive des neurones dopaminergiques dans une structure du tronc cérébral de la taille d’un haricot : la substance noire. Au sein des neurones survivants, on observe la formation d’agrégats de protéines alpha-synucléine, dont la fonction dans le cerveau est encore mal connue.
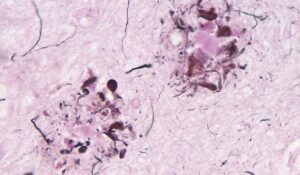
Dans le cas de la MA, ce sont les protéines tau et amyloïdes bêta qui semblent jouer un rôle dans son apparition. Chez les personnes en bonne santé, celles-ci sont bénéfiques aux neurones : « On sait que la protéine tau est impliquée dans le cytosquelette des axones, leurs importants “échafaudages” pour le transport axonal et la communication synaptique. Concernant les amyloïdes bêta, ce n’est pas encore très clair, mais elles sembleraient intervenir dans la communication entre neurones », explique Gilles Vandewalle, maître de recherches FNRS, codirecteur du GIGA-CRC Human Imaging de l’ULiège, et responsable du laboratoire Sleep and Heath.
… des protéines qui empoisonnent le cerveau
Pour une raison qu’on ignore, ces protéines s’accumulent naturellement dans le cerveau au fil du temps. « Tout le monde est, un jour ou l’autre, concerné. Cela peut commencer dès l’adolescence pour la protéine tau, et après la cinquantaine pour l’amyloïde bêta. Ce qu’on ne comprend pas, c’est que certaines personnes résisteront à une accumulation relativement importante, quand d’autres y seront plus vulnérables », indique le Pr Vandewalle.
« Dans le cas de la MA, les protéines tau vont s’agréger au sein même des neurones et former des enchevêtrements fibrillaires, tandis que certaines amyloïdes bêta vont former des plaques autour des neurones. »
Le sommeil, victime collatérale
Un aspect moins connu de ces maladies est qu’elles impactent les nuits de ceux qui en sont atteints. « Leur cerveau fonctionne moins bien, qu’il soit à l’état d’éveil ou au repos. Dès lors, le sommeil est altéré et moins récupérateur », résume le Pr Vandewalle. Preuve que la problématique suscite l’intérêt des spécialistes, la nouvelle revue française « Syn’Alz » de la Fondation Recherche Alzheimer, a choisi les dernières découvertes sur les interactions entre la maladie et le sommeil comme thématique de son premier numéro, sorti en février 2025.
On sait que les patients Alzheimer souffrent d’un dérèglement du rythme circadien avec une sécrétion de mélatonine diminuée et irrégulière. Chez les parkinsoniens, le système veille-sommeil et les cycles sont susceptibles d’être affectés, car les agrégats d’alpha-synucléine peuvent aussi atteindre le locus coeruleus. Il y a quelques semaines, le Dr Vandewalle et ses collègues ont démontré que cette petite structure du tronc cérébral joue un rôle actif dans la régulation du sommeil humain.
« Le locus coeruleus est la seule source de noradrénaline du cerveau, un composé essentiel pour être éveillé et dont la diminution permet le sommeil. Cette structure intervient également dans l’alternance entre le sommeil lent et paradoxal, qui ne peut se produire que lorsque la noradrénaline est totalement absente du cerveau. Le locus coeruleus doit donc se taire. S’il ne le fait pas, ou de manière incomplète, cela perturbe les cycles du sommeil. »
A noter que des protéines tau s’accumulent aussi dans cette structure, suggérant qu’elle pourrait avoir de l’importante dans la MA.
Troubles du sommeil, un facteur de risque à part entière ?
Une grande question est de savoir si les troubles du sommeil, au-delà du symptôme, représentent un facteur de risque dans l’apparition de ces neuropathologies. Pour la MA, les preuves restent limitées : « L’insomnie pourrait en être un. Mais le lien est encore flou. En revanche, on sait depuis quelques années que le sommeil permet de nettoyer le liquide céphalorachidien des déchets métaboliques, comme les protéines tau et amyloïdes bêta. Donc un mauvais sommeil entraînerait potentiellement une accumulation de ces protéines. » Toutefois, comme on l’a vu, leur accumulation ne suffit pas, à elle seule, à déclencher ces maladies.
Dans le cas de la MP, il est avéré que certains troubles du sommeil favorisent sa survenue. Le syndrome des jambes sans repos – un besoin irrépressible de bouger les jambes, souvent au moment de l’endormissement – augmente ainsi le risque de 1 à 5 %. Le trouble du comportement en sommeil paradoxal (TCSP) constitue, quant à lui, un véritable signe précurseur. « Plus de 91 % des personnes atteintes de TCSP développeront la MP dans les 10 à 15 ans. Cela se manifeste par des terreurs nocturnes et des mouvements violents du corps en phase paradoxal ». Identifier les personnes qui souffrent de TCSP permet donc de détecter longtemps à l’avance la maladie et offre une fenêtre de temps importante pour un traitement.

Une connexion à explorer
Des recherches supplémentaires restent indispensables pour mieux appréhender ces interactions plus en profondeur. Dans cette optique, le projet SLEEP-CONNECTION (2023-2025) dirigé par Gilles Vandewalle et financé par la Fondation « Stop Alzheimer » , la Fédération Wallonie-Bruxelles et l’ULiège, s’intéresse à la relation entre le sommeil et le risque génétique de développer la MA, et si cette association implique le locus coeruleus. Dans ce cadre, lui et son équipe analysent l’activité cérébrale, à l’éveil et en sommeil, de 100 sujets en bonne santé, de tous les âges. Des données qui sont croisées avec leur score polygénique – à ce jour, une trentaine de mutations sont associées au risque de développer la MA.
En parallèle, le Pr Vandewalle et son collègue, le Pr Pierre Maquet, participent au projet européen IRONSLEEP (2022-2025), piloté par l’Institut Max-Planck de neurologie et des sciences cognitives (Allemagne). Il vise à mieux comprendre les liens entre troubles du sommeil et progression de la MP aux stades précliniques, en se focalisant, à nouveau, sur le locus coeruleus, et sur les régions sous-corticales en général.
L’étude repose sur l’analyse de l’activité cérébrale à l’éveil et en sommeil de 150 sujets, parmi lesquels figurent : des participants de la cohorte SLEEP CONNECTION, dont le risque polygénique de développer la MP est évalué ; des individus en bonne santé présentant un risque génétique connu ; des patients aux premiers stades de la MP ; et des patients souffrant d’un TCSP ou d’un syndrome des jambes sans repos.
Le sommeil, une piste sérieuse de prévention
« Pour l’heure, nous avons étudié la structure et le fonctionnement du cerveau à l’éveil des participants recrutés pour ces deux projets. On se concentre désormais sur l’activité de leur cerveau en sommeil, en utilisant un électroencéphalogramme ». Avec des premiers résultats prometteurs : « On a déjà pu montrer que la quantité de sommeil paradoxal, même à 20 ans, est plus importante chez les individus à risque de développer la MP. Tandis que la quantité de sommeil lent est plus élevée chez les jeunes participants à risque de développer la MA. »
Afin d’enrichir les données, un autre outil d’imagerie de pointe sera par la suite exploité : l’IRMf 7 Tesla. Le seul appareil de ce type en Belgique est d’ailleurs installé à l’ULiège. « Etant donné que le locus coeruleus, ainsi que la substance noire, sont des structures particulièrement petites, il est crucial d’utiliser une imagerie à très haute résolution, et cette technologie offre une résolution supérieure aux autres. Elle permet aussi d’acquérir des informations qui, jusqu’ici, n’étaient obtenues que par des analyses de tissus extraits par biopsie ou lors de dissections. »
Ces études, toujours en cours, ouvrent la voie à une meilleure compréhension des liens entre sommeil, Alzheimer et Parkinson et, peut-être, demain, à des stratégies de prévention ciblées. Un nouveau projet, HISTOPARK, est d’ores et déjà sur les rails pour approfondir les recherches initiées à travers IRONSLEEP.
Si la qualité de nos nuits ne détermine pas à 100% notre avenir neurologique, elle pourrait constituer une piste sérieuse chez les personnes présentant des prédispositions génétiques, « et, potentiellement, modifier la trajectoire d’évolution de ces maladies », conclut Gilles Vandewalle.
Cette enquête dénommée SLEEP (SommeiL, Eclairage, Enjeux et Perspectives) a bénéficié du soutien du Fonds pour le journalisme en Fédération Wallonie-Bruxelles.

