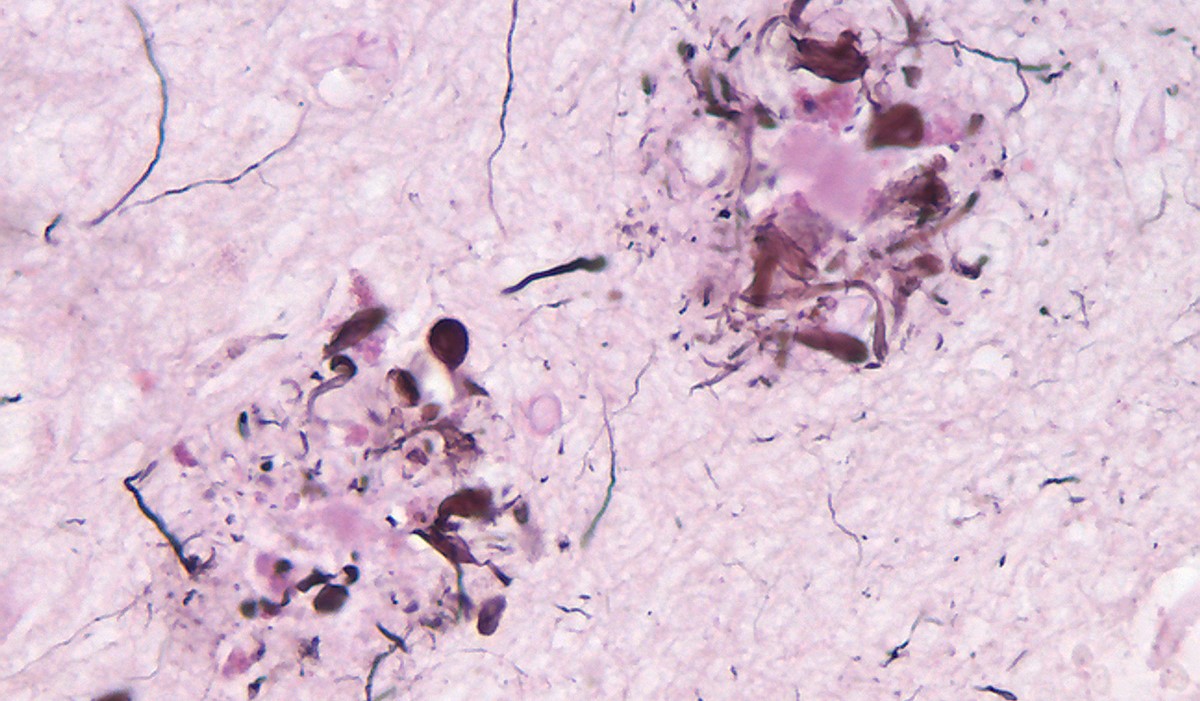
La maladie d’Alzheimer (MA) continue de représenter un défi médical majeur à mesure que sa prévalence augmente dans la population. La Ligue Alzheimer estime qu’en Belgique que près de 138.000 personnes souffrent de cette pathologie. Face à l’absence de traitements curatifs, les efforts de recherche se multiplient pour comprendre les mécanismes sous-jacents de cette maladie et identifier de nouvelles cibles thérapeutiques. C’est dans cette optique qu’une étude récente réalisée par la Pre Carmen Burtea, professeure de biologie cellulaire et chercheuse à l’Université de Mons, et son équipe, s’est penchée sur une approche diamétralement opposée aux techniques existantes : le ciblage de la phospholipase A2 cytosolique (cPLA2).
Une maladie, plusieurs facteurs
La MA, caractérisée par une destruction lente et irréversible des cellules cérébrales, peut être observée en étudiant certains biomarqueurs. Le premier est la peptide amyloïde-β (Aβ) qui s’agrège et forme des plaques amyloïdes ou plaques séniles – c’est-à-dire des agrégats qui se forment autour des neurones, principalement composés de peptide bêta-amyloïde. Le deuxième biomarqueur est l’hyperphosphorylation de la protéine tau (une protéine jouant un rôle dans la structure des neurones et le maintien de leurs réseaux de transport interne).
« Ces deux biomarqueurs majeurs sont très bien connus dans le cadre de la MA. Ils entraînent une neurodégénérescence et au final, une atrophie du cerveau. Mais jusqu’à présent, nous ne connaissions pas les mécanismes responsables de ces phénomènes. Pourquoi ces plaques amyloïdes et cette hyperphosphorylation de la protéine tau apparaissent-elles ? Ces questions sont à l’étude depuis des dizaines d’années, mais aucune réponse définitive n’a encore été trouvée » explique la Pre Burtea.
Face à ce constat, la chercheuse s’est penchée sur le lien entre certains enzymes agissant sur les membranes cellulaires et le développement de la MA. Pourquoi ? Car l’hydrolyse de la protéine précurseur d’amyloïde (PPA), responsable des plaques amyloïdes, se produit au niveau membranaire. La molécule responsable du déclenchement de ces phénomènes devait dès lors être un enzyme capable d’hydrolyser des phospholipides membranaires, donc les lipides qui composent les membranes cellulaires, connus pour moduler l’activité des protéines membranaires.
« La PPA est hydrolysée en conditions physiologiques (normales, NDLA). Mais en conditions pathologiques (anormales, NDLA), certains enzymes protéolytiques (enzymes qui coupent les protéines) sont activés et coupent cette protéine pour générer un peptide amyloïde. Et ces phénomènes se produisent au niveau des membranes cellulaires ».
C’est en suivant cette réflexion que la Pre Burtea a mis le doigt sur la phospholipase A2 cytosolique (cPLA2). Cette phospholipase (enzyme qui hydrolyse les phospholipides), vient cliver les acides gras qui entrent dans la composition des phospholipides de la membrane cellulaire, notamment l’acide arachidonique. Or, si en conditions normales, cet acide joue un rôle important dans le bon fonctionnement du cerveau, en conditions pathologiques celui-ci s’accumule et génère des dégâts en provoquant des réactions inflammatoires.
En approfondissant ses recherches, la Pre Burtea a constaté que cet acide arachidonique activait (via des kinases, sortes de petits ouvriers moléculaires qui vont aider certaines réactions cellulaires à se faire) toute une série de processus. Notamment la phosphorylation de la protéine tau (rappelez-vous, c’est l’un des grands biomarqueurs de la MA). Ainsi que l’expression de la PPA et des enzymes protéolytiques (responsables des plaques amyloïdes, l’autre grand biomarqueur de la MA).
Cette phospholipase serait l’une des causes possibles de l’apparition des deux grands biomarqueurs de la MA.
Face à constat, la Pre Burtea et son équipe se sont penché sur un moyen de venir bloquer ou, en tout cas, diminuer l’activité de cet enzyme et ont développé un peptide (PLP25). Et ce, par la technique du phage display (exposition d’une bibliothèque de peptides par des virus qui infectent les bactéries), capable d’inhiber l’activité de cet enzyme de manière réversible. Ce peptide agit en modulant indirectement l’activité de la cPLA2 et permet une réduction de la libération d’acide arachidonique. Ce faisant, ce procédé permet de venir atténuer les processus pathologiques de la MA liés à cet acide.
Une approche innovante
Si des études ont déjà été réalisées concernant le rôle inflammatoire de la phospholipase cytosolique, ces dernières ne se sont pas penchées sur les mécanismes qui conduisent à l’expression de la PPA et à la phosphorylation – qui est un processus qui aide à contrôler ce qui se passe à l’intérieur des cellules en agissant comme un interrupteur qui permet à la cellule de réguler quand et comment certaines activités doivent se produire, FUTURA- de la protéine tau, rappelle la Pre Burtea.
L’approche thérapeutique de ce traitement, encore hypothétique rappelons-le, diffère des stratégies existantes concernant la MA. « Notre approche est complètement différente, car nous ciblons un carrefour au niveau de plusieurs voies cellulaires. Et ce, alors que les autres approches ciblent une seule molécule, à savoir le peptide amyloïde et la protéine tau, mais ne s’attaquent pas à la cause de leur apparition » précise la chercheuse. D’autant plus qu’utiliser un peptide comporte des avantages. En effet, celui-ci déclenche peu d’effets immunogènes par rapport à l’utilisation d’une protéine et est également peu toxique.
Bien que des expériences in vitro et in vivo aient déjà livré quelques résultats prometteurs, cette nouvelle voie thérapeutique nécessite encore d’être confirmée par d’autres études.
« Nous sommes en train de déposer des projets pour continuer ces études. Nous avons quelques résultats qui semblent confirmer notre hypothèse, mais la recherche nécessitera encore beaucoup d’études pour valider l’effet thérapeutique de notre peptide», conclut la Pre Burtea.
Pour l’instant, la chercheuse aspire à identifier toutes les molécules entrant en ligne de compte dans les processus complexes en œuvre dans la MA. Les chercheurs souhaitent, à l’avenir, se focaliser sur toutes les kinases (les protéines qui phosphorylent d’autres protéines pour activer ou réguler leurs fonctions) afin de prouver que le processus mis en lumière dans cette étude est bien le bon.