La phagothérapie est le traitement d’infection bactérienne par des phages. Bien qu’existant depuis presque un siècle, la médecine occidentale commence seulement à s’y intéresser sérieusement. Elle la considère comme l’alternative la plus prometteuse aux antibiotiques.
C’est en tout cas le pari du projet européen de grande ampleur, Phagoburn, auquel participent plusieurs équipes belges. Son but : produire des phages suivant les normes standardisées GMP, (Good medicine practice), et tester leur efficacité dans des essais cliniques.
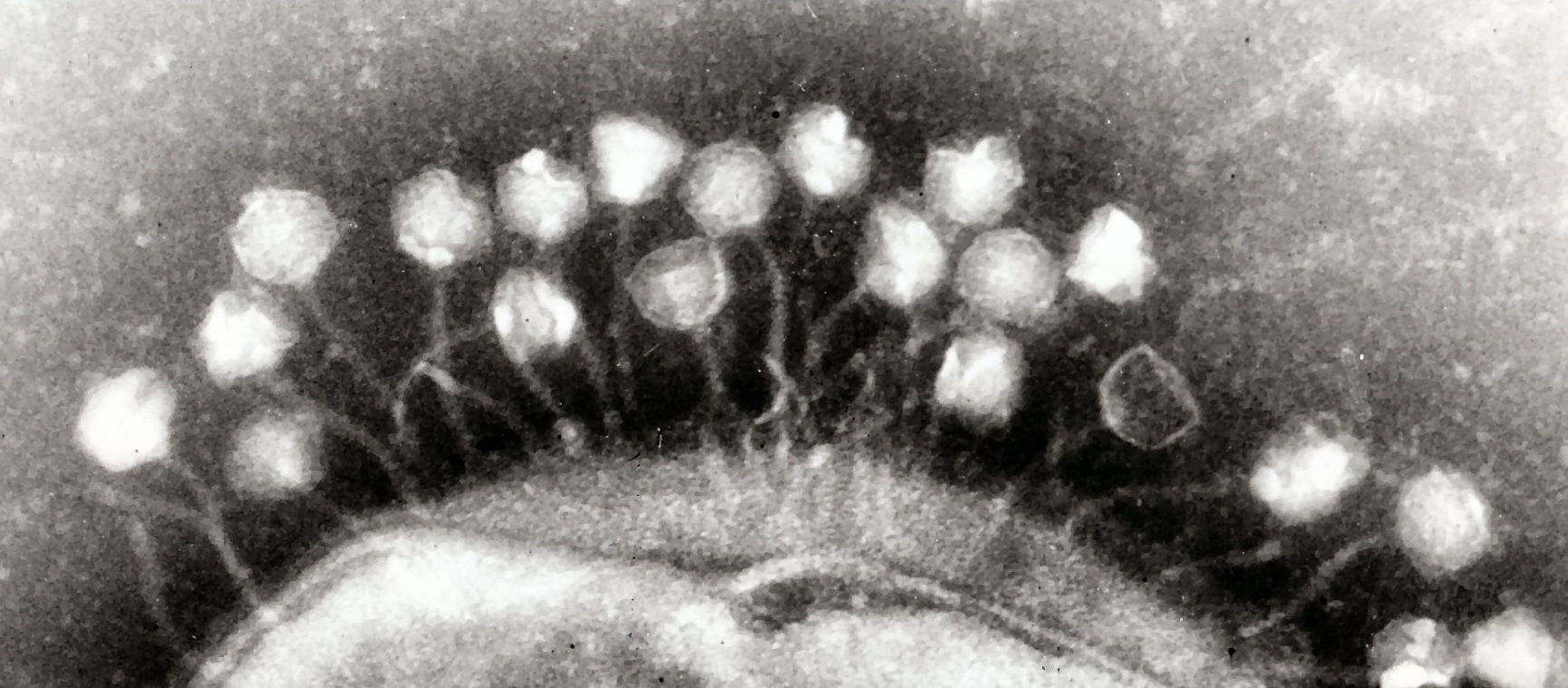
Les phages existent depuis des millions d’années et se retrouvent dans tous les biotopes. Inoffensifs pour l’homme, ceux-ci se révèlent redoutables quand il s’agit de lutter contre les bactéries pathogènes. Ils pourraient être un complément idéal aux antibiotiques.
Bactériophage et bactérie, un couple qui dure
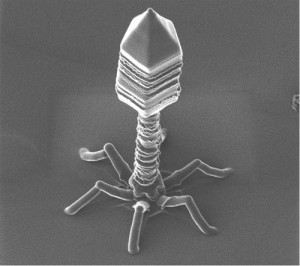
Les bactériophages ont été découverts il y a un siècle mais, en 1928, Alexandre Fleming découvre la pénicilline, et les antibiotiques sont privilégiés aux phages. Production plus facile, molécules brevetables, action bactéricide à large spectre, l’antibiotique est devenu l’antibactérien le plus utilisé dans le monde. Avec les problèmes de résistance que l’on connaît aujourd’hui…
La recherche commence donc à se tourner vers la phagothérapie depuis quelques années.
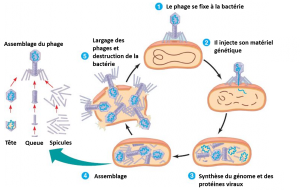
« Il faut voir le couple bactérie/bactériophage comme une entité qui évolue ensemble. Un peu comme une relation hôte-parasite. Les phages régulent les populations de bactéries, et inversement » explique Daniel De Vos, chercheur microbiologiste à l’Hôpital Militaire Reine Astrid.
« Le phage n’a pas intérêt à éradiquer complètement la bactérie. Un certain équilibre doit être maintenu. La phagothérapie doit donc être utilisée en complément d’un antibiotique. Ou pour faire en sorte de réduire le nombre de bactéries pour permettre au système immunitaire de prendre le dessus. »
Phagothérapie vs antibiotiques
Par rapport aux antibiotiques, le bactériophage présente plusieurs avantages, comme l’explique le Dr Jean-Paul Pirnay, chercheur au laboratoire de technologie moléculaire et cellulaire de l’hôpital Reine Astrid.

« Un phage est très souvent spécifique à une espèce de bactérie, voire même une souche. Contrairement aux antibiotiques qui s’attaquent à plusieurs espèces de bactéries, même celles qui ne sont pas pathogènes ».
« L’utilisation de phages permet donc d’éviter beaucoup d’effets secondaires. De plus, le phage va co-évoluer avec sa bactérie, c’est-à-dire s’adapter aux résistances qu’elle pourrait développer. Et puis le phage est auto-réplicateur, autrement dit, il se réplique lui-même dans son environnement. »
Des phages difficilement brevetables
Les phages présentent des avantages indéniables par rapport aux antibiotiques. Mais le phage est une entité qui évolue. Il est donc difficilement brevetable. D’où le manque d’intérêt des firmes pharmaceutiques. Ou alors, il faudrait commercialiser des mélanges de phages à large spectre.
« Ce qui nous conduirait aux mêmes problèmes de résistance que l’on a avec les antibiotiques aujourd’hui… » précise le Dr Pirnay.
« Pour que la phagothérapie soit réellement efficace, il faut considérer deux méthodes d’utilisation des phages. D’un côté, il y a la vision durable, où l’on connaît la ou les bactéries pathogènes. On peut alors prescrire un cocktail de phages qui ne va viser que ces bactéries. De l’autre, on trouve l’utilisation à large spectre, où on ne connaît pas exactement la bactérie infectieuse. Un large cocktail de phages va alors détruire un grand nombre d’espèces de bactéries. »
Essais cliniques à Bruxelles, Loverval et Liège
Une étude clinique soutenue par l’Union européenne a donc été lancée il y a deux ans : Phagoburn. Son but est de produire des bactériophages en conditions GMP et de les tester sur les patients.
Deux PME françaises, Pherecydes Pharma et Clean Cells se sont occupées de la production de deux cocktails de phages. Ils doivent permettre de combattre les bactéries Escherichia Coli et Pseudomonas aeruginosa, toutes deux responsables d’infection sur des plaies dues à des brûlures.
Après cette étape, qui a duré deux ans, un essai clinique I/II a été lancé en juillet 2015. Il implique le Service de Santé des Armées français, le centre hospitalier universitaire vaudois en Suisse et en Belgique, à l’hôpital de Loverval, le CHU de Liège et l’hôpital militaire Reine Astrid.
« Le patient doit avoir des plaies infectées, soit par E. Coli, soit par P. aeruginosa., explique le docteur Serge Jennes, chef du service des grands brûles à l’hôpital militaire Reine Astrid. Après le consentement éclairé du patient et de sa famille, il est alors encodé dans la base de données et c’est un programme qui détermine s’il sera traité avec un cocktail de phages, ou simplement avec une crème contre les brûlures. Des frottis sont effectués quotidiennement sur la plaie. De là, des microbiologistes évaluent semi-quantitativement s’il y a une diminution significative du nombre de bactéries de l’espèce visée. Ce traitement dure sept jours ».
Des patients en France, en Belgique et en Suisse
L’objectif de Phagoburn est de réaliser ce traitement sur 220 personnes, réparties dans les différents centres hospitaliers français, suisses et belges.
Au total, cinq patients ont déjà participé à l’essai. Un bon début car il est assez difficile de trouver des patients qui répondent à tous les critères de l’étude. Après cet essai clinique, il reste encore plusieurs étapes avant que ces deux cocktails de phages ne soient admis comme médicament. Un processus qui pourra prendre près de dix années…
« Il y a bien sûr des pressions des firmes pharmaceutiques, qui ne trouvent pas d’intérêt financier dans les phages. Mais peu à peu, on constate une prise de conscience du monde scientifique et des autorités. L’évolution des mentalités va dans le bon sens », conclut le spécialiste.