À quelle vitesse les cellules qui forment des tissus, par exemple celles de notre peau, se déplacent-elles ? Et sous quelles « pressions » ? Ces questions ont été au centre des travaux de la doctorante Danahe Mohammed (UMons) financée par une bourse FRIA/FNRS. Dans le cadre de sa thèse, la chercheuse a étudié la migration des cellules épithéliales qui, au premier regard, ne semblent pas se déplacer.
« Les cellules d’un assemblage collectif ne sont pourtant pas immobiles », explique le Pr Sylvain Gabriele, du service « Interfaces et Fluides Complexes » (UMons), qui a supervisé les travaux de Danahe Mohammed, actuellement chercheuse postdoctorale à l’Université d’Harvard. « Quand on les observe en groupe, elles sont comme un banc de poissons qui changent en même temps de direction ou de vitesse selon les circonstances», précise-t-il. « Je pense par exemple à la cicatrisation d’une plaie ou au développement d’une tumeur. Nous essayons de comprendre à quelle vitesse elles évoluent, comment elles s’organisent pour prendre une certaine direction plutôt qu’une autre ». On parle ici de vitesses qui se mesurent en micron par heure…
Pistes adhésives
Au service « Interfaces et Fluides Complexes » de l’UMons, la physique, la chimie et la biologie sont donc à l’honneur. « Nous nous sommes principalement intéressés aux cellules dynamiques », reprend le scientifique. « Elles doivent à la fois bouger et réorganiser leurs liaisons. Ces dernières sont déjà étudiées depuis longtemps. Nous avons préféré nous intéresser aux vitesses de déplacement ».
Dans un tissu, les cellules épithéliales sont confinées, serrées les unes contre les autres. « Nous avons voulu comprendre quel était le rôle de ce confinement sur leur vitesse de migration », précise Sylvain Gabriele.
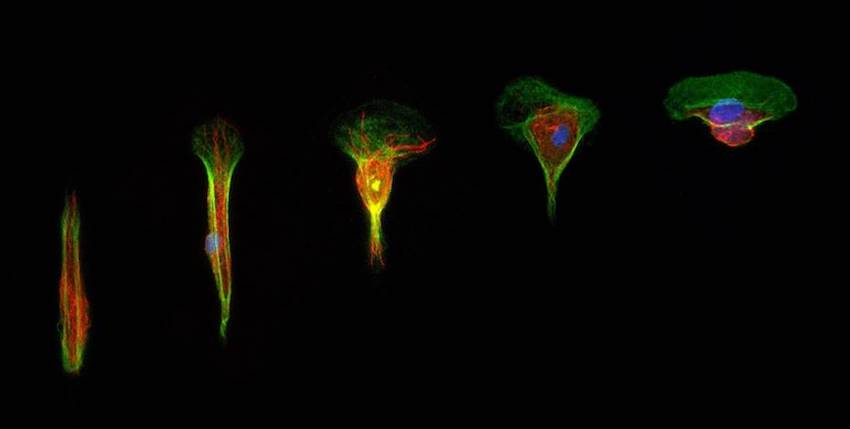
Techniquement plutôt que d’étudier des assemblages collectifs, les chercheurs ont préféré suivre les déplacements de chaque cellule placée dans des conditions de confinement mimant les conditions réelles. « Nous avons créé des pistes adhésives, de l’ordre de 10 à 100 microns de diamètre », précise le scientifique. « La cellule y est confinée, exactement comme si elle l’était par des voisines, au sein d’un tissu. Ces pistes affichent des diamètres variables. Nous avons pu observer leurs vitesses de migration par microscopie, analyser leur forme et leurs déformations, la répartition de leurs organelles. Autant d’éléments qui nous ont renseignés sur les forces en présence.
Écaille de poisson-zèbre
L’équipe a travaillé au départ d’épithélium de poisson et plus précisément des cellules provenant d’écailles de poissons-zèbres. L’avantage du poisson, c’est qu’il vit en milieu liquide. “Quand il est blessé, il doit donc cicatriser très rapidement pour éviter les infections. Résultats, ses cellules épithéliales migrent dix à cent fois plus vite qu’une cellule humaine. Ce qui nous a fait gagner du temps. Un temps que nous avons utilisé pour multiplier les expériences et ainsi obtenir des données de plus ne plus robustes”.
« Ces travaux nous ont permis de démontrer qu’avec ce dispositif, nous pouvons évaluer, au départ de l’étude d’une seule cellule, les paramètres du mécanisme de déplacement cellulaire au sein d’un tissu. Nous avons mis là le doigt sur un acteur clé de la mécanique et du confinement spatial cellulaire », dit encore le Pr Gabriele.
Ces recherches fondamentales pourraient avoir des applications pratiques très rapides. Par exemple du côté de l’industrie pharmaceutique, qui pourrait tester in vitro le pouvoir de cicatrisation de nouveaux médicaments. Ou encore mieux comprendre divers systèmes biologiques, afin de pouvoir les piloter et développer ensuite de nouveaux biomatériaux.