Chaque année, 35.000 personnes perdent la vie en Europe à cause de l’antibiorésistance. Développer de nouvelles stratégies pour continuer à être en mesure de combattre les bactéries pathogènes est une urgente nécessité. C’est dans cette optique que s’inscrit la recherche fondamentale menée par le Pr Stéphane Vincent, du laboratoire de Chimie Bio-Organique de l’UNamur.
Il exploite les potentialités antibactériennes de molécules synthétiques dénommées DCF (Dynamic Constitutional Framework), auxquelles il ajoute d’autres molécules artificielles, les pillararènes. En combinaison avec un antibiotique classique, il a pu démontrer une efficacité jusqu’à 4 fois supérieure à celle de l’antibiotique seul sur Acinetobacter baumannii, l’une des bactéries antibiorésistantes que l’OMS a identifiées comme les plus menaçantes pour la santé humaine. Ce résultat très encourageant doit désormais être consolidé. Ce travail a été réalisé en collaboration avec les laboratoires de microbiologie du Pr Tom Coenye (UGent) et du Pr Charles Van der Henst (VIB-VUB). Un brevet a été déposé afin de protéger une famille de DCF ainsi que différents types de pillararènes.
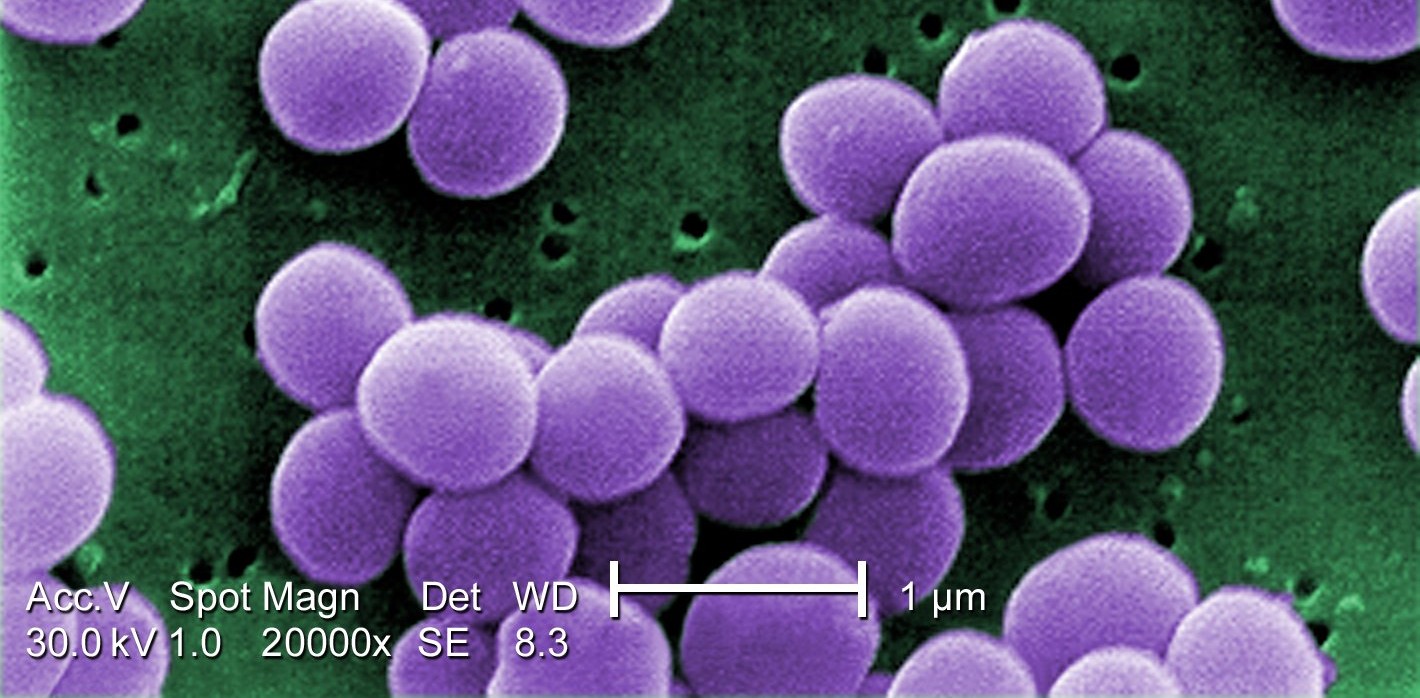
Un pouvoir antibactérien intrinsèque
En tant que polymères, les DCF sont constitués d’unités qui se répètent pour former une macromolécule. Habituellement, ces macromolécules sont rigides, comme celles du polystyrène ou du polyéthylène utilisés dans les bouteilles en plastique. Les DCF, en revanche, se comportent tout autrement : ce sont des polymères dynamiques dont les briques élémentaires sont reliées par des liaisons covalentes capables de se former et de se rompre en permanence. Ce caractère changeant en fait des matériaux dits “adaptatifs”.
Ces grosses molécules sont chargées positivement – on parle de polycations -. Cette caractéristique est partagée avec certains antimicrobiens naturels, et confère aux DCF un pouvoir antibactérien intrinsèque. Cela a d’ailleurs été établi sur Pseudomonas aeruginosa et Staphylococcus aureus, deux bactéries antibiorésistantes très menaçantes pour la santé humaine selon l’OMS.
Des premiers tests de toxicité ont été menés afin d’évaluer la pertinence de mener des recherches sur les DCF en biologie humaine, et les résultats se révèlent rassurants. Les analyses de cytotoxicité indiquent qu’aux doses actives contre les bactéries, les DCF n’endommagent pas les cellules de mammifères. Des tests colorimétriques ont aussi été réalisés pour examiner un éventuel effet sur les globules rouges : dans les conditions expérimentales, aucun signe d’hémolyse n’a été détecté.
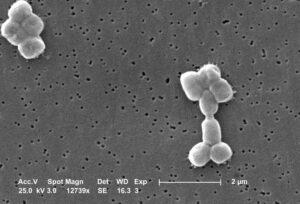
Affaiblir ou détruire les biofilms
Dans le corps humain, les bactéries se regroupent souvent pour former un biofilm adhérant à une surface — comme un implant médical — et se recouvrant d’une matrice protectrice. Ce gel collant protège efficacement les bactéries des attaques du système immunitaire, et même des antibiotiques les plus puissants, ce qui en fait un enjeu majeur de santé publique. Les biofilms sont ainsi impliqués dans de nombreuses maladies nosocomiales, des maladies contractées dans les établissements de soin.
Le Pr Vincent a montré que certains DCF peuvent non seulement inhiber la formation de biofilms, mais aussi les fragiliser, exposant ainsi davantage les bactéries à leur environnement. «Nous avons démontré qu’il est possible de renforcer considérablement l’activité antibactérienne des DCF grâce à une stratégie de drug delivery : un antibiotique initialement peu efficace contre les biofilms voit son action nettement amplifiée par l’utilisation des DCF. »
L’union fait la différence
Pour acheminer l’antibiotique au plus près du biofilm, le chercheur a eu l’idée d’associer aux DCF des pillararènes, des molécules synthétiques déjà explorées dans des applications antivirales.
On peut se représenter le dispositif comme une vaste cage : le DCF en constitue l’ossature dynamique, tandis que les pillararènes jouent le rôle de briques élémentaires. Ce « véhicule » peut ainsi être transporté jusqu’au plus près du biofilm, où il libère progressivement l’antibiotique contenu en son sein.
Les premiers tests ont été réalisés avec la lévofloxacine, un antibiotique qui s’est révélé particulièrement efficace lorsqu’il est associé au système DCF-pillararène, allant jusqu’à atteindre les bactéries les plus profondes du biofilm, normalement protégées par son architecture. « Le nombre de CFU — c’est-à-dire de colonies bactériennes vivantes — a été mesuré. Les résultats révèlent une diminution drastique de la quantité de bactéries, y compris au cœur du biofilm, confirmant ainsi l’efficacité du dispositif », explique Pr Stéphane Vincent.
Un mécanisme encore obscur
Avec son équipe, il tente désormais de découvrir les mécanismes d’action de la combinaison DCF-pillararène. « Mon hypothèse est que comme les matrices de biofilm contiennent de l’ADN et des polysaccharides, tous deux anioniques, cela laisse de fortes chances à nos molécules cationiques d’interagir avec elles et de pénétrer à l’intérieur du biofilm où elles libèrent l’antibiotique. Dans un premier temps, nous allons regarder, grâce à la microscopie confocale à fluorescence, si les DCF pénètrent bel et bien à l’intérieur du biofilm.»
La deuxième étape, actuellement en cours dans le cadre d’une collaboration en Allemagne, consiste à étudier comment le DCF affecte la bactérie, ou plus précisément certaines de ses fonctions. « On sait, en effet, que le contact entre la membrane externe d’une bactérie et certains polycations peut provoquer une fragilisation de la bactérie. Nous cherchons donc à déterminer si nos DCF polarisent et affaiblissent la membrane bactérienne », poursuit Pr Vincent.

Une double attaque
Le trio DCF-pillararène-antibiotique permet de tuer des bactéries protégées par un biofilm, mais permettrait-il de lutter contre l’antibiorésistance ? Car, s’il reste des survivantes dans la colonie, celles-ci pourront s’adapter…
Ce à quoi le Pr Stéphane Vincent répond : « Il est vrai que le système n’est pas efficace à 100 %. Cependant, il faut rappeler que le DCF possède déjà une activité antibactérienne et antibiotique, même sans ajout d’un antibiotique. Lorsqu’on y associe une molécule antibiotique, il devient beaucoup plus difficile pour les bactéries de se défendre contre cette double attaque. On peut donc espérer que les mécanismes classiques de résistance seront inefficaces face à ce système, qui n’est pas une simple petite molécule isolée, mais une macromolécule dynamique. »
L’un des domaines d’application les plus prometteurs de cette innovation concerne non pas le traitement direct des infections, mais leur prévention. « L’objectif est d’utiliser ces DCF en combinaison avec des pillararènes pour des traitements de surface afin d’empêcher la formation de biofilms, par exemple sur des cathéters ou des prothèses, et ainsi contribuer à réduire le risque de maladies nosocomiales », conclut Pr Stéphane Vincent.