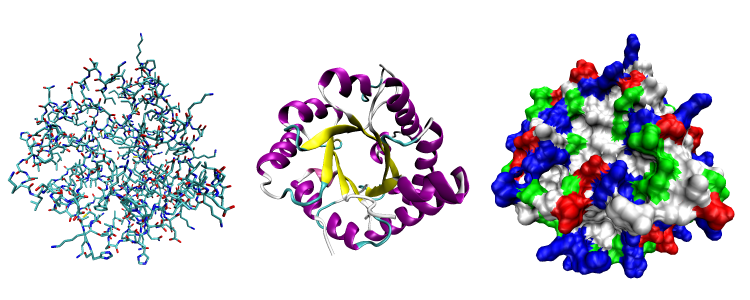
Elle répond au nom de GroEL. Jusqu’ici, les scientifiques pensaient que cette protéine ultra connue dans les laboratoires fonctionnait en solo. Mais les travaux de l’équipe de Jean-François Collet, chercheur à l’Institut de Duve de l’UCLouvain et investigateur au sein du WEL Research Institute, viennent de remettre en question cette croyance : sous leur objectif, ils ont photographié une interaction avec une autre entité biochimique dans le but de protéger les cellules.
Se replier pour fonctionner
Chaque cellule vivante produit des milliers de protéines, briques indispensables à la vie. Lorsqu’elles sont fabriquées, ces entités prennent la forme d’un long filament. Sous cette forme, les protéines sont inactives. Pour être fonctionnelles, elles doivent adopter une forme particulière : on parle du repliement des protéines, par exemple, en forme d’hélice.
Certaines maladies, comme la maladie d’Alzheimer ou la maladie de Parkinson, sont liées à des problèmes de repliement de protéines.
Une chaperonne qui ne travaille pas seule
Les cellules vivantes produisent des chaperonnes qui aident les protéines à se replier rapidement et correctement, notamment en cas de danger. L’une d’elles, dénommée GroEL, a été énormément étudiée par la communauté scientifique et est utilisée comme exemple dans de nombreux manuels de biologie.
Le monde scientifique pensait tout connaître à son sujet… jusqu’à ce que des chercheurs de l’UCLouvain découvrent que GroEL travaille, en réalité, avec un partenaire jusqu’ici inconnu, désormais dénommé CnoX, pour fonctionner correctement. Cette interaction entre GroEL et CnoX a été capturée en photos par les scientifiques.
Cette découverte est le fruit des travaux menés par Emile Dupuy et Camille Goeman de l’équipe de Jean-François Collet, en collaboration avec d’autres collègues de l’UCLouvain (Yves Dufrêne), de la VUB, du Laboratoire européen de biologie moléculaire, du CNRS et de l’Université du Nebraska.
« Cette découverte, si elle n’a pas d’impact direct sur les patients ou les traitements, permettra à tout le moins aux scientifiques du monde entier de mieux étudier la manière dont les protéines survivent dans la cellule. Permettant, notamment, des avancées dans la compréhension des mécanismes impliqués dans des maladies telles que celles d’Alzheimer ou de Parkinson », mentionne l’UCLouvain.