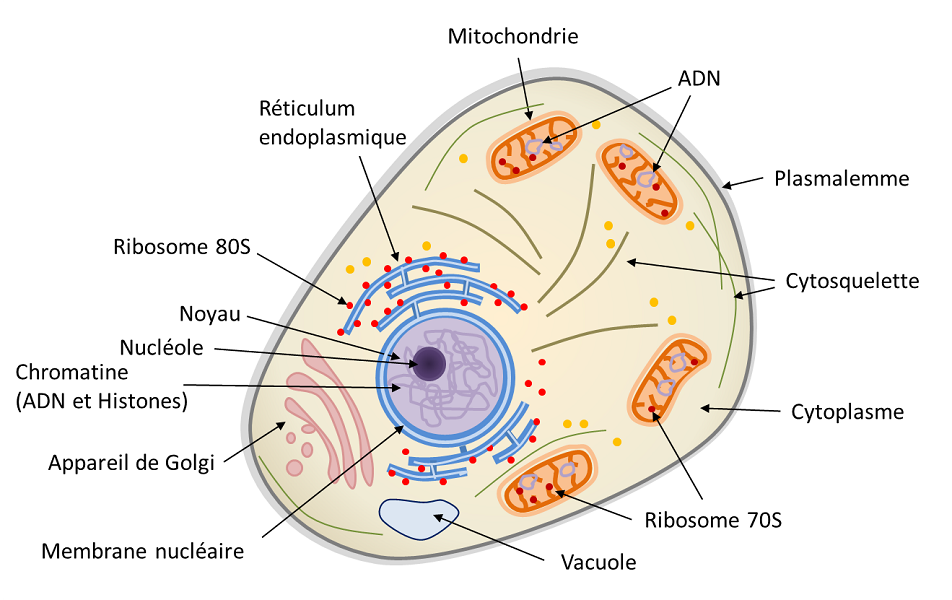
Une membrane contenant du cytoplasme, dans lequel baigne toute une série d’organites (dont un noyau), qui assurent l’activité de l’ensemble de l’unité organique. Voici, en substance, de quoi se constituent nos cellules.
Parmi les organites, le réticulum endoplasmique, découvert dans les années 50, joue un rôle particulièrement central dans le métabolisme de la cellule. Néanmoins, son fonctionnement n’est pas encore totalement compris par les scientifiques.
Une étude internationale pilotée par le laboratoire de Réseaux d’Interactomes Viraux et celui d’Expression des Gènes et Cancer du Giga Molecular Biology of Diseases (ULiège) permet aujourd’hui d’en apprendre plus sur sa dynamique. Des découvertes qui aideront non seulement à mieux comprendre certaines maladies, mais aussi à développer de nouveaux médicaments.
Le réticulum endoplasmique, usine à gaz de la cellule
Le réticulum endoplasmique (RE) forme un réseau de membranes qui entoure, en couches, le noyau. Il peut être considéré comme l’usine de la cellule, car c’est à travers lui que la cellule synthétise les protéines à secréter dans l’organisme, mais aussi celles qui constituent sa membrane externe et ses membranes internes. De plus, le RE est en interaction constante avec les autres organites cellulaires, comme le noyau, l’appareil de Golgi et les mitochondries.
« Grâce aux dernières avancées technologiques en microscopie, surtout la super-résolution (Prix Nobel de chimie en 2014), et la microscopie électronique à froid (Prix Nobel de chimie de 2017), permettant d’observer les complexes moléculaires à l’échelle d’une seule molécule, des scientifiques ont été capables d’identifier, il y a quelques années, les protéines constitutives de ce réseau membranaire », indique le Pr Jean-Claude Twizere, maître de recherches FNRS, et responsable du Laboratoire de Réseaux d’Interactomes Viraux.
Mais la régulation de l’activité de ces protéines, et leurs effets sur les fonctions du RE restent assez méconnus. Mieux cerner cette dynamique était l’objectif du projet piloté par l’ULiège.
L’intérêt étant, à terme, d’améliorer notre compréhension de certaines maladies, comme les cancers, les maladies cardiovasculaires, ou encore la maladie d’Alzheimer. « Dans le cas de ces maladies, la communication entre les différents organites cellulaires est perturbée. Les échanges entre cellules s’en retrouvent donc altérés, ce qui a pour conséquence de compliquer les actions de défense de l’organisme », rappelle le Pr Twizere.
Des technologies de pointe mobilisées
Dans une étude précédente, l’équipe du Pr Twizere avait déjà découvert que l’une de ces protéines, la glycosyltransférase exostosine-1 (EXT1), était capable d’induire la dégradation d’un oncogène responsable de certains types de leucémie. « Mais nous n’avions pas réussi alors à déterminer les mécanismes moléculaires responsables de cette suppression », informe le Pr Twizere.
Dans cette nouvelle étude, les scientifiques ont cherché à comprendre le rôle de l’enzyme EXT1 dans le RE. « Pour y parvenir, nous avons combiné des techniques de biologie moléculaire et de biologie cellulaire. L’intervention de plusieurs équipes belges et internationales a ainsi été guidée par l’idée d’intégrer plusieurs technologies, telles que l’imagerie de haute résolution, l’interactomie (l’étude des interactions moléculaires dans une cellule particulière et leurs conséquences), ou la bio-informatique. »
En Belgique, le projet a réuni l’expertise de trois autres unités de recherche du centre liégeois (GIGA-I3, GIGA-Cancer, GIGA-Neurosciences), de même que des scientifiques du Cancer Research Institute Ghent (CRIG), du VIB Center for Cancer Biology (KU Leuven), et du Duve Institute (UCLouvain).
Exploiter des cellules à l’activité boostée
Concrètement, les chercheurs ont analysé des cellules au sein desquelles EXT1 était soit diminuée, soit supprimée, dans le but d’en déterminer les effets sur le RE.
Leurs analyses ont révélé que cette protéine est un régulateur clé de la morphologie et de la dynamique de l’organite. Ils ont, en effet, découvert que diminuer l’expression de EXT1 provoque l’extension de la taille du réseau membranaire du RE. Ce qui engendre, chez la cellule, une augmentation de son activité métabolique. « Dans le cas des cellules cancéreuses, cette augmentation de l’activité les rend plus sensibles à l’élimination in vivo », note le Pr Twizere.
Les conclusions de cette étude pourraient avoir des retombées dans le domaine médical, mais aussi dans le domaine biotechnologique : « Diminuer l’expression de la protéine permettrait d’obtenir des cellules super-productrices. Nous menons d’ailleurs un projet, soutenu par le programme Win2Wal de la région wallonne, dont le but est d’explorer la possibilité de fabriquer des cellules animales dont le réseau du RE serait étendu. Ces cellules représenteraient d’excellents outils de production de vecteurs viraux, utilisés en thérapie génique ou dans les vaccins », conclut le chercheur.